脂肪酸、有机酸和植物提取物的混合物对接种球虫疫苗的肉鸡肠道形态和炎症基因表达的影响
市场部 袁振
翻译整理自泰高动物营养加拿大农业研究中心和加拿大圭尔夫大学人类健康与营养科学系的合作研究
摘要
促进胃肠道健康的饲料添加剂可以作为无抗肉鸡生产系统中球虫疫苗接种计划的补充。本研究测试了一种商业饲料添加剂混合物(FA)对接种球虫疫苗的罗斯708公鸡(N=2160)肠道组织形态学和炎症生物标志物的影响。该研究采用完全随机区组设计(12个区组),采用3种日粮处理:CON(阴性对照)、AGP(阳性对照:55 ppm亚甲基水杨酸杆菌肽)和FA (小鸡1.5 kg/MT;中鸡1.0 kg/MT;大鸡0.5 kg/MT)。在重复使用的垫料上饲养雏鸡,分3阶段饲喂(小鸡0 ~ 14 天;中鸡15至28天,大鸡29至36天;每个饲喂阶段准备一个基础日粮,在制粒前将基础日粮与相应的试验原料混合制成最终试验日粮。生长性能测定,包括每栏体重和采食量,以及在整个研究过程中采集新鲜粪便样本。第20天,从一组鸡群 (n = 72, 1个区组)中收集肠道组织样本,检测组织形态学及紧密连接基因和炎症基因的mRNA表达。在十二指肠,FA(和AGP)组的绒毛长度与隐窝深度之比显著低于CON组。与CON组相比,FA组和AGP组空肠iNOS、IFNƔ和claudin-1的相对mRNA表达上调;FA组的反应程度小于AGP组。综上所述,FA组改变了十二指肠的微观结构,影响了空肠中炎症基因的表达。这些变化的时间与粪便中卵囊的排出高峰以及观察到的饲料效率降低的时间一致。
关键词
球虫,无抗,饲料添加剂,胃肠道

概述
球虫病是由艾美耳球虫属的单细胞原生动物寄生虫引起的家畜和家禽寄生虫病。寄生虫在胃肠道(GIT)中增殖,引起血便、脱水和肠道病变(Trees, 2008)。 对肉鸡而言,球虫病引起的病变是产气荚膜梭菌引起的坏死性肠炎的易感因素。全球肉鸡行业与坏死性肠炎相关的经济损失如生长性能下降等,估计达到60亿美元(Wade和Keyburn, 2015)。在常规生产中,球虫病是通过在饲料(或水中)施用抗球虫药和抗生素来预防和管理的。然而,随着家禽生产中减少(取消)抗生素和离子载体药物使用的压力越来越大,需要其他策略来进行补充。
在家禽无抗生产中预防球虫病的一种方法是接种疫苗。由活的孢子卵囊组成的疫苗可诱导适应性免疫,从而导致肠上皮损伤并诱发局部炎症(Williams,2002; Dalloul and Lillehoj, 2005; Stringfellow et al.,2011)。这种压力与生长性能下降相关联(Li et al.,2005)。 支持肠道完整性和功能性、减轻炎症或具有微生物修饰特性的饲料添加剂可以补充疫苗接种,为无抗家禽生产中的疾病管理提供了另一种方法。 事实上,研究表明肉鸡生产中有几种促生长抗生素 (AGP)的天然替代品,包括益生元、益生菌、有机酸、酶和植物提取物(Sethiya,2016年)。 含有多种成分的混合添加剂具有商业可操作性,并可能通过多种机制提供影响GIT健康的机会。
一种由脂肪酸、有机酸和植物提取物组成的专利商业混合物“FA”已经开发出来,并在无抗生产系统中饲养的肉鸡身上进行了测试。 在我们实验室进行的研究发现,在整个生产周期内饲喂FA会增加体重,降低料肉比(F:G)(未发表)。 据推测,生长性能的提高部分归因于肠道完整性和功能的改善,但这一观点仍有待证实。本研究的目的是研究FA对孵化场接种球虫疫苗的肉鸡GIT完整性和炎症反应标志物的影响。通过组织形态学和紧密连接基因评估胃肠道完整性,也会检验参与炎症反应的基因的相对表达。期望饲喂商业产品(FA)会支持GIT的健康和功能。
材料与方法
-
动物与饲养
动物实验于2017年8月22日至9月28日在泰高动物营养肉鸡研究中心(Burford, ON, Canada)进行。 动物试验程序由泰高动物营养动物福利委员会根据加拿大动物福利委员会的指导方针(1993年)批准。从Maple Leaf Food孵化场(Hanover, ON,Canada)购买共计2160只罗斯708公鸡,在那里它们接种了马立克疫苗,传染性支气管炎和球虫病疫苗(Immucox3,CEVA,Cambridge, ON, Canada)。 在泰高动物营养肉鸡研究中心接收1日龄雏鸡,随机分配到36个地面围栏(60只/栏)。 每个围栏密度0.07平方米/只,其中保留了之前鸡群的木屑垫料,并用于诱导环境压力。垫料在放置前用PLT家禽垃圾处理剂(Jones-Hamilton,Walbridge OH)进行处理,推荐用量为49 ~ 73 kg/100 m2,以控制氨气水平。在本次研究中,氨气浓度在任何时候都不超过25ppm,垫料湿度(含水)保持在25%至35%。
-
试验设计
本研究采用完全随机区组设计,共有12个区组和3个试验处理。处理组包括商业产品(FA) (Selko b.v., Tilburg,the Netherlands),不含添加剂或药物的阴性对照(CON)和药物阳性对照(AGP)。鸡群采用3阶段商业饲喂程序:小鸡(0至14天),中鸡(15至28天)和大鸡(29至36天)。 每个饲养阶段配制一个基础日粮(Yantzi Feed and Seed,Tavistock, ON, Canada),满足或超过NRC(1994)的家禽能量和营养需求(表1)。
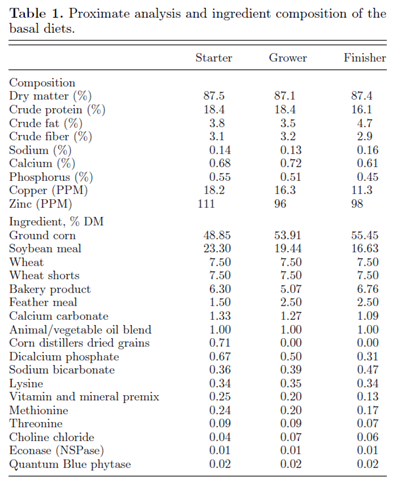
试验日粮是将基础日粮与相应的试验原料混合制成的。在AGP处理中,在每个日粮中加入亚甲基水杨酸杆菌肽(Zoetis Canada Inc., Kirkland, QC, Canada) (0.5 kg/MT;55 PPM杆菌肽)。FA组根据制造商的建议,在小鸡日粮中添加1.5 kg/MT的FA,在中鸡日粮中添加1.0 kg/MT的FA,在大鸡日粮中添加0.5 kg/MT的FA。CON组日粮中不含抗球虫药、其他药物或添加剂。从每个生产批次中取出10个等间隔的日粮样品,进行混合和二次取样,为后期近红外光谱(NIRS DS2500, Foss, Hilleroed, Denmark) (shurr - gain Laboratory, St. hyacins, QC, Canada)的营养分析提供代表性的组合。
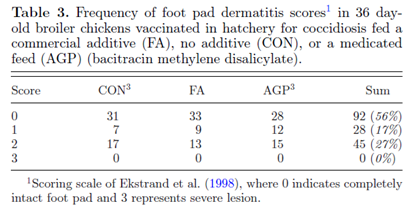
每个围栏单独给料,鸡群可以自由采食和饮水。 分别于第7、14、20、28和36天记录每栏鸡群采食量和体重,计算平均体重、平均日采食量和饲料转化率(F:G)。每天监测鸡群的健康状况,记录死亡情况,并由有执照的兽医确定死亡原因。圭尔夫大学(MAFF, 1986)使用McMaster技术在第7、20和28天测定粪便中的卵囊数量,作为疫苗摄入的指标。在试验的最后一天,在每个围栏中随机选择5只鸡,使用4分制对脚垫完整性进行评分(Ekstrand et al.,1998),其中0表示脚垫完全完好,3表示严重损伤。
-
肠道取样与分析
第20天,从整个区组中选取24只鸡(n = 72)进行颈椎脱位安乐死。立即从十二指肠袢处的十二指肠、梅克尔憩室处的回肠和盲肠(中段)处采集组织样本(1.5至2.0 cm),用PBS冲洗,并保存在10%中性缓冲福尔马林中。72h后,将组织转移到PBS中,21℃保存,以备之后的组织学分析。从梅克尔憩室空肠取组织样本(300 ~ 350mg),置于RNA后期溶液中,4℃保存24 h,然后转移至-20℃,以待后续mRNA表达分析。
为了进行组织学分析(圭尔夫大学病理生物学系),在载玻片上对肠组织段切片(4 μm厚),并用苏木精和伊红染色。绒毛的测量从绒毛顶端的上皮表面到绒毛底部,以相邻隐窝上皮的开始为界。选择明显存在于一个绒毛基部或两个连续绒毛之间的隐窝;尽量选择显示笔直轮廓的隐窝。在盲肠中测量黏液腺的长度。使用cellSens软件(Olympus Canada Inc., Richman Hill, ON, Canada)进行测量。测量十二指肠 (40倍放大,补充图S1),回肠和盲肠 (100倍放大,补充图S2)的绒毛和隐窝。尽可能多地从同一片区域里选取绒毛。连续拍摄其他图像,直到每个样本完成6个绒毛和6个隐窝的测量。
如前所述,完成基因表达分析(Peppler et al.,2016)。 在提取RNA之前,将样品吸干RNA并置于均质管中。样品在1ml QIAzol中均质,使用RNeasy迷你试剂盒提取RNA,包括无DNA酶污染处理。利用高容量cDNA反转录试剂盒,添加RNaseOUT,将2 μg的RNA合成互补DNA。PCR板在BioRad CFX实时荧光定量PCR仪上运行,用iTaq Universal SYBR Green Supermix和无RNA酶水制备。白细胞介素-2 (IL-2)、白细胞介素-6 (IL-6)、白细胞介素-10 (IL-10)、诱导型一氧化氮合酶(iNOS)、干扰素γ (IFNγ)、occludin闭合蛋白、Claudin-1 (CLDN-1)、Claudin-2 (CLDN-2)和支架蛋白ZO2的引物由圭尔夫大学实验室服务处(补充表S1)根据已发表的文献配制(Wang et al.,2012;Osselaere et al.,2013;Yu et al.,2015;Song et al., 2017;Zhang等,2017)。2-ΔΔCT方法用于定量基因表达(Livak和Schmittgen, 2001), Gapdh作为管家基因。
-
计算及统计分析
饲料转化率调整至正常体重(初始F: G - [(BW-2.41 kg) x 0.24])。 在SAS Studio (v9.4)中分析数据。生长分析的试验单位为每个围栏,P<0.05为统计学显著。连续数据在SAS的GLIMMIX程序中建模,处理和时间及其相互作用考虑固定效应,并阻断随机变异源。对每个围栏随时间的重复测量进行建模,采用最适合模型的协方差结构(AIC值最低)。使用Slice函数分离均值,并使用simulation方法调整P值以适应多重性。对于所有模型,条件学生化残差都进行了正态性和线性检验。采用模拟方法进行多重两两比较。脚垫评分采用多项分布进行分析。 组织学数据和mRNA表达数据采用非参数Kruskal-Wallis检验和Dunnet检验进行多重比较,以鸡只为试验单位。
结果
-
组织学
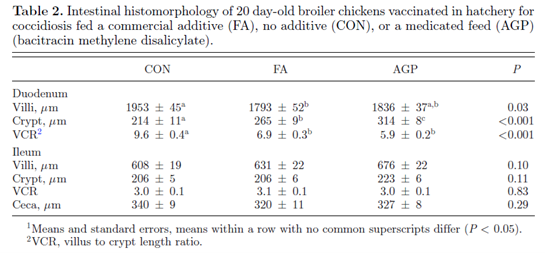
十二指肠和回肠的绒毛长度和隐窝深度以及盲肠黏液腺的长度见表2。 FA组的十二指肠绒毛显著短于CON组的十二指肠绒毛。 FA和AGP两组十二指肠绒毛长度相近。 FA组的隐窝深度显著高于CON组,而AGP组的隐窝深度显著低于CON组。 FA组的绒毛长度/隐窝深度(VCR)显著低于CON组,与AGP组差异不显著。各处理组间回肠的绒毛长度和隐窝深度(及比值)以及盲肠黏液腺长度均无显著差异。
-
基因表达分析
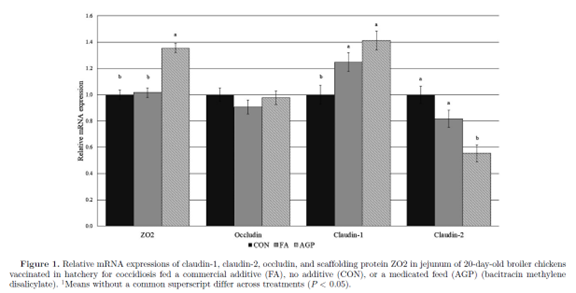
紧密连接蛋白CLDN-1、CLDN-2、occludin、ZO2的相对mRNA表达量如图1所示。FA组的Claudin-1 mRNA表达量显著高于CON组, FA与AGP之间差异不显著。FA组和CON组在CLDN-2、occludin和ZO2的相对表达量上无显著差异。与FA组和CON组相比,AGP组Claudin-2显著下调,ZO2显著上调。 这些结果表明,AGP处理影响了几个紧密连接基因的表达,而FA只诱导了CLDN-1的表达。
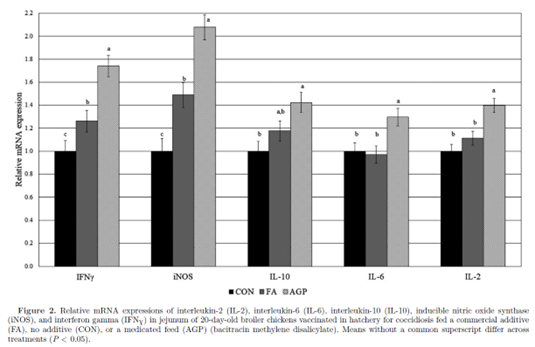
细胞因子IL-2、IL-6、IL-10 mRNA表达见图2。对于IL-1和IL-2, FA组与CON组mRNA表达量无显著差异;然而,与FA组和CON组相比,AGP组的表达明显上调。 对于IL-10 mRNA的表达量, FA组和CON组及 AGP组相比均无显著差异(AGP显著大于CON组)。 与CON组相比,FA组的iNOS和IFNƔ相对mRNA表达量显著上调,但仍显著低于AGP组。综上所述,FA诱导的肠道炎症反应程度小于AGP。
-
动物健康与生长
研究期间未观察到临床疾病暴发。各处理组之间的累积死亡率无显著差异(CON 3.6%, FA3.2%, AGP 2.3%)。同样,脚垫评分(第36天)在不同处理组间无显著差异(表3)。大多数动物(56%)的得分为0,表明脚垫完全完好。各处理对粪便中卵囊计数无显著影响(图3),处理与时间之间没有相互作用。总的来说,各组处理没有显著影响动物的健康参数。
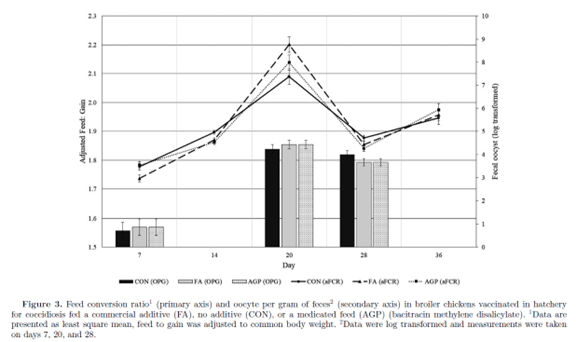
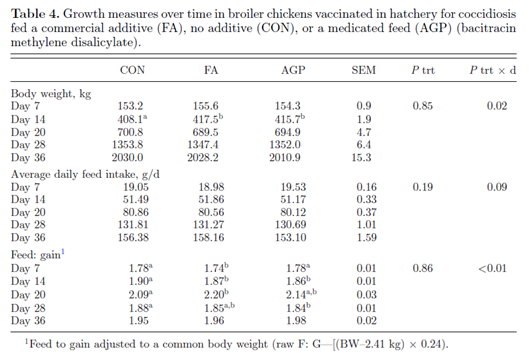
对时程生长性能数据的重复测量分析(表4)发现,各处理与时间对体重有显著的相互作用(P = 0.005)。 具体而言,在小鸡阶段(第14天),FA组的体重显著高于CON组,但与AGP组差异不显著(表4)。对于调整后的F: G,各处理和时间之间的相互作用也同样显著 (表4,图3)。 在小鸡阶段(第7天和第14天),FA组的鸡群F: G显著低于CON组。相反,第20天时FA组的鸡群F: G显著高于CON组。无论第28天还是第36天,FA组与CON组或AGP组之间的F: G均无显著差异。 无论哪组处理,F: G都在第20天最高,与卵囊排出高峰一致(图3)。总之,这些研究结果表明,与CON组相比,FA组的鸡群在小鸡阶段(第0天至第14天)的生长性能(体重和F: G)有所改善。在中鸡和大鸡阶段,FA对生长性能的有益作用逐渐减弱。
讨论
球虫病是影响肉鸡的主要肠道疾病。接种活疫苗会引入低剂量的艾美耳球虫,引发针对寄生虫的细胞反应(Dalloul和Lillehoj, 2006年)。 除了免疫激活的能量成本外,肠道中寄生虫的再循环会造成损伤和炎症,使动物容易发生继发性感染 (Moore,2016)。本研究调查了脂肪酸、有机酸和植物提取物的混合物FA的潜在功效,以帮助减轻在不使用抗生素或离子载体的情况下饲养的肉鸡接种疫苗的负面影响。 研究结果表明,FA处理改变了十二指肠和空肠的微观结构,诱导了炎症反应,与AGP组的鸡群相比,炎症反应减弱。
第20天采集肠道样本,评价各组处理对肠道形态的影响。与CON组鸡群相比, FA组(和AGP组)的鸡群十二指肠绒毛长度更短,隐窝深度更深,导致VCR降低。更深的隐窝和更低的VCR表明细胞增殖增加以更新绒毛(Gao等,2008)。 与此一致的是,卵囊排出在第20天时最高,可能有助于增加上皮细胞周转率。实际上,通常鸡只需要通过粪便重新摄入排出的疫苗株卵囊3个循环才能实现获得性免疫(Peek和Landman, 2011)。 由于没有对微生物群进行量化,并且没有完成病变评分,因此在本研究中无法证实这一假设。然而,在感染球虫病的家禽中,十二指肠上皮损伤和局部炎症已被证实(Lillehoj和Trout, 1996)。 堆型艾美耳球虫优先定植于十二指肠,是本研究中使用的疫苗的一个组成部分。该疫苗也包含柔嫩艾美耳球虫和巨型艾美耳球虫的孢子卵囊。 柔嫩艾美耳球虫通常感染盲肠,而巨型艾美耳球虫则定植于回肠(Trees, 2008)。然而,在本研究中,各处理之间没有发现回肠和盲肠腺体形态的差异。本研究未对空肠进行组织形态学测量,在未来的实验中应考虑到这一点,因为巨型艾美耳球虫和堆型艾美耳球虫可以感染空肠(Trees,2008)。
空肠是营养物质消化和吸收的主要部位(Svihus, 2014)。鉴于这一重要作用,本研究收集了空肠样本,以检测肠屏障功能和炎症的标志物。与CON组相比,FA组和AGP组紧密连接蛋白CLDN-1 mRNA的相对表达量均上调。与CON组和FA组相比,AGP组的CLDN-2表达下调,ZO2表达上调。CLDN-1主要具有屏障功能,而CLDN-2具有成孔作用(Gunzel和Yu, 2013)。 在本研究中,我们无法证实在FA组和AGP组中观察到的CLDN-1的上调如何与屏障的完整性和通透性相关。 未来的工作需要将肠道通透性测定与基因表达分析相结合。在AGP组的鸡群中,CLDN-2的下调和支架蛋白ZO2的上调可能会进一步加速肠道屏障的重塑。总之,这些发现表明,FA组鸡群的反应强度小于AGP组。然而,本研究的紧密连接基因数量较少限制了对这些发现的解释。
与形态和紧密连接基因表达的变化一致,各处理也改变了炎症基因的表达。 与CON组相比,FA组的促炎细胞因子IFNƔ和iNOS的mRNA表达上调。 AGP组鸡群表现出更高的两种细胞因子的上调。此外,与CON组相比,AGP组对IL-6有显著的诱导作用。IL-6的诱导可能一部分与之前讨论的观察到的CLDN-2表达上调有关(al - sadi等人,2014)。之前对肉鸡的研究表明,在艾美耳球虫攻毒时,促炎细胞因子表达上调(Laurent et al., 2001)。在急性艾美耳球虫攻毒研究中,IFNƔ在感染后增加到200倍,并持续升高7 天。进一步的证据表明,IFNƔ通过破坏艾美耳球虫的复制,对艾美耳球虫具有直接的抑制作用(Lillihoj和Choi, 1998)。由于这些原因,IFNƔ的上调被认为是对寄生虫感染的强大免疫应答的一个关键组成部分(Lillihoj和Choi, 1998)。与细胞因子诱导同等重要的是应答的幅度和持续时间。 炎症反应的加剧需要付出高昂的能量代价。对于快速生长的动物如肉鸡而言,发动免疫反应所需的能量占用了生长和维持所需的能量和营养( Lochmiller和Deerenburg, 2000;Humphrey和Klasing, 2004)。在小鸡阶段(0 ~ 14 D), FA组的生长性能优于CON组和AGP组。有趣的是,在球虫复制高峰期,FA组观察到的高效率在第20天消失,然后在第28天恢复。这些结果表明,FA组的鸡群能够迅速从球虫病的挑战中恢复。目前尚不清楚在小鸡阶段观察到的体重和饲料效率优势是否与FA剂量相关。根据厂家推荐,FA剂量在中鸡阶段降低,在大鸡阶段再次降低。生长性能的改进可能具有剂量特异性或存在产品效力的关键时期。这些假设值得进一步研究。在本研究中,AGP并未改善生长性能,而缺乏反应可能与过度使用导致的低敏感性有关(Slavi´c et al., 2011)。杆菌肽是一种窄谱抗生素,通过减少肠道梭菌来预防坏死性肠炎。杆菌肽对接种球虫疫苗的肉鸡的疗效,特别是在没有继发性细菌感染的情况下,需要进一步评估。另外,免疫激活可能会损害AGP组鸡群的生长性能。与CON组相比,AGP组鸡群的促炎细胞因子表达增加了2倍,而FA组鸡群的反应更迟钝。此外,与CON组和FA组相比,AGP组鸡群的肠道重塑标志物增加。
结论
本研究旨在探讨FA(脂肪酸、有机酸和植物提取物的混合物)作为一种抗菌剂替代药物对接种球虫疫苗的肉鸡的影响。结果表明,与CON组相比,FA组鸡群在十二指肠中的VCR降低,在空肠中诱导了促炎细胞因子的产生。与AGP组鸡群相比, FA组鸡群的这些反应的幅度受到了抑制。与胃肠道结构和炎症反应的变化一致,FA处理导致了饲料效率的下降(第20天),随后在中鸡阶段得到恢复。总之,这些结果表明,能量从瘦肉生长转移到免疫系统,从而实现对艾美耳球虫的先天免疫。然而,我们需要对肠道完整性和相关免疫激活进行更全面的评估。
补充数据
补充数据可在Poultry Science网站获得。
补充表S1. 用于目标基因和管家基因(GAPDH)定量的引物。
补充图S1. 20日龄肉鸡十二指肠组织形态学。
补充图S2. 20日龄肉鸡回肠组织形态学。
致谢及参考文献略。